پشتیبانی از دانلود های ناموفق
پاورپوینت شیمی آلی 1 سه واحد درسی
خرید و دانلود آنی
شماره پشتیبانی
09103705578
شیمی آلی 1 سه واحد درسی
شیمی آلی 1
شیمی آلی 1 در سه واحد درسی امروز ما می خوایم در سایت دانشکده ها این جزوه دانشگاهی را برای دانشجویان عزیز قرار دهیم
که این جزوه در یک فایل پاورپوینت در 179 اسلاید زیبا و جذاب تهیه و تنظیم شده است
منابع : شیمی آلی 1 –انتشارات دانشگاه پیام نور
فهرست 1- اتم -پیوند – ملکول 2- آلکانها 3- آلکنها 4- دی انها 5- آلکین ها 6- شیمی فضائی 7-آلکیل هالیدها 8- واکنشهای آلکیل هالیدها 9- بنزن و آروماتیسیته 10- واکنشهای الکتروندوستی آروماتیکی
فصل اول
اتم – پیوند-ملکول
شیمی آلی : شیمی مربوط بھ ترکیبات کربن دار
تمایل و توانائی کربن برای پیوند با یکدیگر و
تشکیل زنجیرھای طویل یا حلقھ ھا
ترکیبات کربن دار:
ترکیبات طبیعی
اسید ھای چرب –پروتئین ھا- نوکلئیک اسیدھا – ھیدراتھای کربن
ترکیبات سنتزی
داروھا – رنگھا-پلیمرھا-پلاستیکھا-حشره کشھا
:
مدل ھای اتمی
مدل اتمی رادرفورد
مدل اتمی بوھر
مدل اتمی تامسون
مدل اتمی ابر الکترونی
الکترونھا در مدارھای دایرھای بھ دور ھستھ در گردش می باشند
وجود الکترونھا در فاصلھ بین این مدارھا مجاز نیست و انرژی آنھا کوانتائی است
کوانتائی بودن انرژی
توصیف الکترون با
اعداد کوانتائی
عدد کوانتمی اصلی
نحوه توزیع الکترونھا در اربیتالھا و آرایش الکترونی
قواعد اصل طرد پاولی
در یک اتم دو الکترون ھرگز نمی توانند دارای چھار عدد کوانتومی یکسان باشند
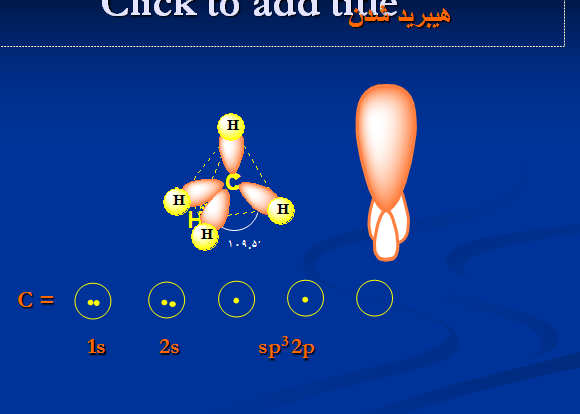
C =
1s 2s 2p
قاعده ھوند
۱. الکترونھا ابتدا مدارھای خالی را بھ صورت تک تک اشغال می کنند.
اربیتال اتمی کربن
H H
CH2
1s 2s 2p
C =
H H H H
CH4
تئوری اربیتال ملکولی
ترتیب پر شدن اربیتالھای ملکولی کھ انرژی آنھا با ھم برابر نیست بدین ترتیب است کھ ابتدا اربیتالی کھ کمترین انرژی را دارد پرمی شود و با ترتیب پیش می رود.
ھر اربیتال ملکولی حداکثر دو الکترون می تواند در خود جای دھد.
اربیتال ملکولی یک پیوند کوولانسی معمولا شامل دو الکترون است.
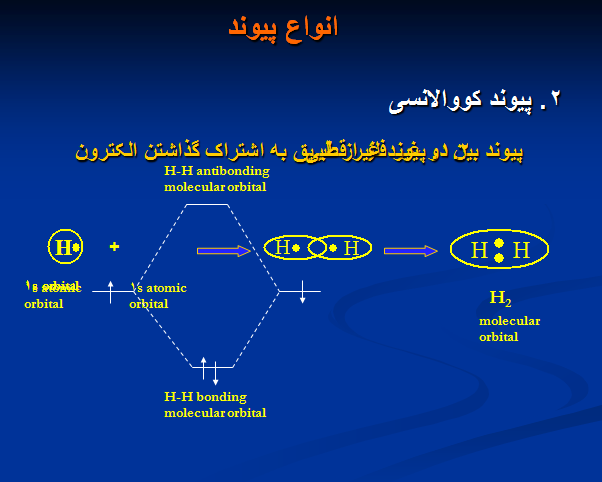
بھ ھنگام پر شدن اربیتالھای ملکولی ھم انرژی پیش از آنکھ یکی از انھا دو الکترون بگیرد باید ھر یک از انھا یک الکترون در یافت کرده باشد.فرض اصلی : پیوند کووالانسی وقتی تشکیل می شود کھ
اربیتالھای اتمی مجزا و متفاوت با ھم ھمپوشانی نمایند. و اربیتالھای ملکولی را تشکیل دھند.
قواعد برای پر کردن اربیتالھای ملکولی :
انواع پیوند ها
۱. پیوند الکترواستاتیکی
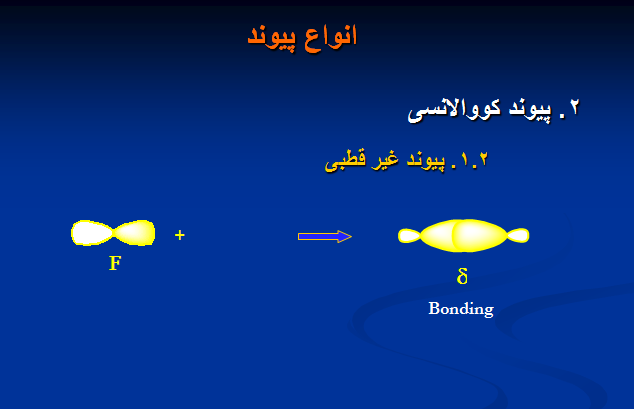
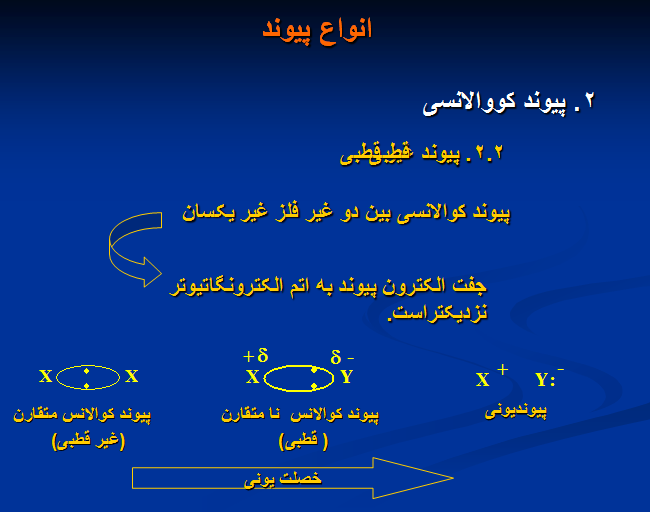
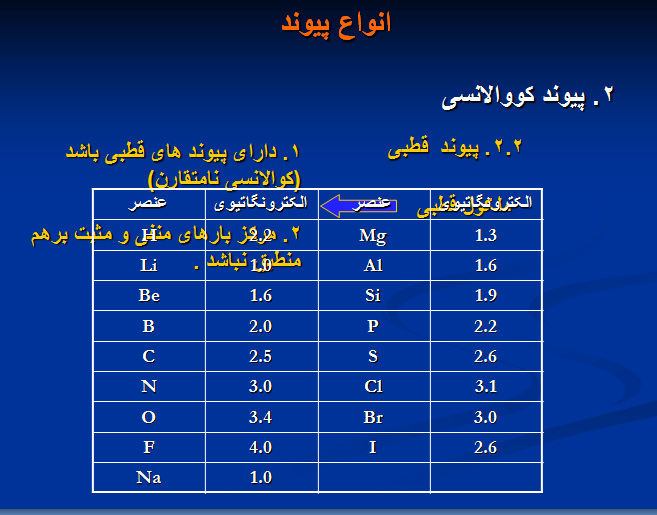
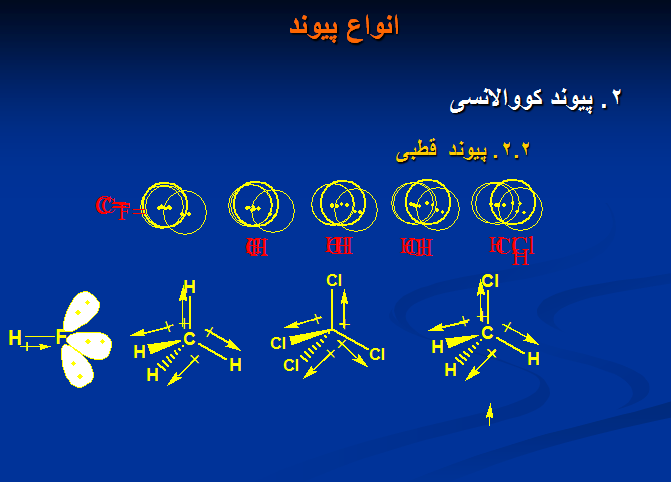
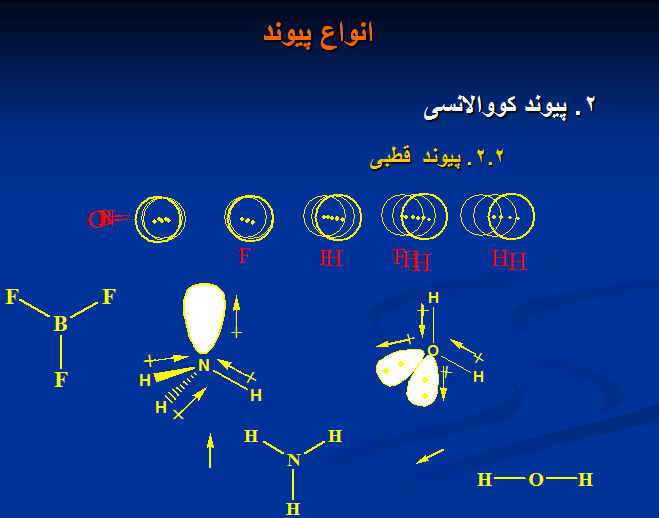
۲. پیوند کووالانسی
۳. پیوند فلزی
در اثر جاذبھ بین اجزاءبا بار مخالف تشکیل می شود
پیوند بین دو یون
۱.۱ . پیوند یون –یون ( یونی)
غیر فلز فلز
Na Cl
e-
+ Na + + Cl
–
ھمگی جامدند –نقطھ ذوب بالا دارند – در شبکھ بلوری یونھا
نقاط کاملا معینی را اشغال می کنند
Na Br, LiF, MgCl2, KBr : مانند
انواع پیوند
۱. پیوند الکترواستاتیکی
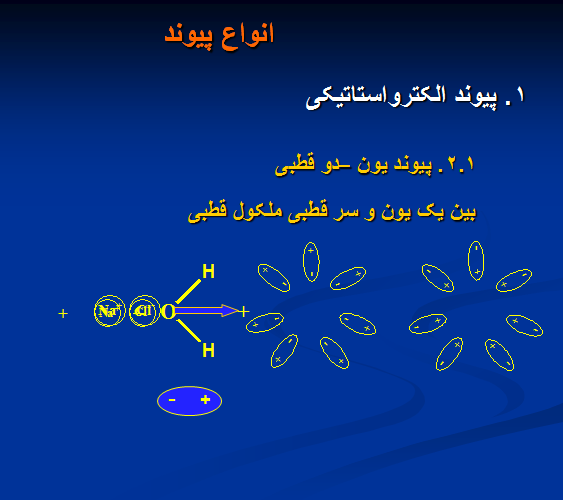
بین یک یون و سر قطبی ملکول قطبی
۲.۱ . پیوند یون – دو قطبی
۱. پیوند الکترواستاتیکی
بین دو سر قطبی دو ملکول قطبی مانند پیوند ھیدروژنی
۳.۱ . پیوند دوقطبی – دو قطبی



اولین نفری باشید که دیدگاهی را ارسال می کنید برای “پاورپوینت شیمی آلی 1 سه واحد درسی”
برای ثبت نقد و بررسی وارد حساب کاربری خود شوید.












دیدگاهها
هیچ دیدگاهی برای این محصول نوشته نشده است.